

Topamax
JANSSEN- CILAG FARMACÊUTICA LTDA.
Topamax®
Informações ao Paciente
Comprimidos / Cápsulas
topiramato
Formas Farmacêuticas e apresentações
Comprimidos:
Comprimidos revestidos de 25 mg em embalagens com 60 comprimidos.
Comprimidos revestidos de 50 mg em embalagens com 60 comprimidos.
Comprimidos revestidos de 100 mg em embalagens com 60 comprimidos.
Cápsulas:
Cápsulas de 15 mg e 25 mg em embalagem com 60 cápsulas.
Uso adulto e pediátrico
Informações Gerais
Marca Comercial: Topamax®
Princípio Ativo: topiramato
Classe Terapêutica1: Anticonvulsionantes
Composição
Cada comprimido revestido de 25 mg contém:
topiramato ........................................... 25 mg
Excipientes: amido de milho, amidoglicolato de sódio, celulose microcristalina, cera de carnaúba, estearato de magnésio, lactose2 e opadry branco.
Cada comprimido revestido de 50 mg contém:
topiramato ........................................... 50 mg
Excipientes: amido de milho, amidoglicolato de sódio, celulose microcristalina, cera de carnaúba, estearato de magnésio, lactose2 e opadry amarelo claro.
Cada comprimido revestido de 100 mg contém:
topiramato .......................................... 100 mg
Excipientes: amido de milho, amidoglicolato de sódio, celulose microcristalina, cera de carnaúba, estearato de magnésio, lactose2 e opadry amarelo.
Cada cápsula de 15 mg contém:
topiramato ........................................... 15 mg
Excipientes: acetato de celulose, esferas de açúcar3 e povidona.
Externamente (cápsula): dióxido de titânio e gelatina.
Cada cápsula de 25 mg contém:
topiramato ........................................... 25 mg
Excipientes: acetato de celulose, esferas de açúcar3 e povidona.
Externamente (cápsula): dióxido de titânio e gelatina.
Ação esperada do medicamento
Topamax® é um medicamento anticonvulsivante, com múltiplos mecanismos de ação, eficaz no tratamento da epilepsia4 e na profilaxia da enxaqueca5. O topiramato influencia vários processos químicos no cérebro6, reduzindo a hiperexcitabilidade de células nervosas7, que pode causar crises epilépticas e crises de enxaqueca5.
Cuidados de armazenamento
As embalagens de Topamax® devem ser mantidas em temperatura entre 15o e 30oC, protegidas da umidade.
Prazo de validade
Ao adquirir o produto, verifique na embalagem externa se ele obedece ao prazo de validade. Não tome medicamento com o prazo de validade vencido. Pode ser perigoso para a sua saúde8.
Gravidez9 e Lactação10
Informe ao seu médico a ocorrência de gravidez9 na vigência do tratamento ou após o seu término. Informar ao médico se está amamentando. Não se recomenda o uso de Topamax® durante a gravidez9 e a lactação10. Se ocorrer gravidez9 durante o tratamento com Topamax® , seu médico deverá ser avisado.
Cuidados de administração
Siga as instruções do seu médico, respeitando sempre os horários, as doses e a duração do tratamento. Em geral, Topamax® deve ser tomado duas vezes ao dia. Contudo, seu médico poderá recomendar que você tome o medicamento uma vez ao dia, ou em doses maiores ou menores.
Há 3 tipos de comprimidos de Topamax® , cada um contendo uma quantidade diferente de topiramato. Você pode identificar a concentração dos comprimidos pela sua cor e formato:
- Comprimidos redondos e brancos: contém 25 mg de topiramato;
- Comprimidos redondos e amarelos-claros: contém 50 mg de topiramato.
- Comprimidos redondos e amarelos: contém 100 mg de topiramato.
Seu médico começará o tratamento com uma dose baixa, aumentando-a gradativamente, até atingir a dose adequada ao controle de sua epilepsia4. Tome os comprimidos com bastante água, sem parti-los, triturá-los ou mastigá-los. Se preferir, você pode tomar Topamax® junto com as refeições. Se você esquecer de tomar uma dose, tome-a assim que você se lembrar. Porém, se você estiver perto da hora de tomar a próxima dose, não tome a dose que você esqueceu e continue o tratamento normalmente. Se, acidentalmente, você tomar uma dose muito grande de Topamax® , procure imediatamente o seu médico.
Além dos comprimidos, há 2 tipos de cápsulas de Topamax® , cada uma contendo uma quantidade diferente de topiramato e identificadas pela gravação 15 mg e 25 mg. As cápsulas podem ser tomadas inteiras ou podem ser abertas com cuidado e o seu conteúdo adicionado a uma colher de chá de alimento pastoso. Esta mistura deve ser ingerida imediatamente, não devendo ser guardada para uso posterior.
Em crianças, o tratamento é iniciado com uma dose baixa que é aumentada gradativamente até atingir a dose ótima para controle das crises epilépticas.
Pacientes idosos
As doses recomendadas são válidas também para pacientes11 idosos. Não há necessidade de ajuste das doses, desde que esses pacientes não tenham doença nos rins12.
Interrupção do tratamento: não interromper o tratamento sem o conhecimento do seu médico. Verifique sempre se você tem a quantidade necessária de comprimidos ou cápsulas e nunca deixe que faltem.
Efeitos colaterais13
Qualquer medicamento pode provocar reações desagradáveis. Informe seu médico o aparecimento de reações desagradáveis, como as listadas a seguir, ou quaisquer outros sinais14 ou sintomas15 desagradáveis. Os efeitos colaterais13 mais freqüentes são: problemas de coordenação; alterações do pensamento, incluindo dificuldade de concentração, lentidão de pensamento e confusão; tontura16; cansaço; formigamento; sonolência. Também podem ocorrer, embora menos freqüentemente: esquecimento, agitação, diminuição do apetite, distúrbios da fala, depressão, distúrbios da visão17, alterações do humor, náusea18, alterações do paladar19, perda de peso e formação de pedras nos rins12, cujos sinais14 são presença de sangue20 na urina21 ou dor na parte inferior das costas22 ou dor na área genital.
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
Ingestão concomitante com outras substâncias
Avise seu médico a respeito de outros medicamentos que você esteja tomando, inclusive aqueles que você comprou sem receita médica e quaisquer outros remédios ou suplementos dietéticos que você esteja usando. É muito importante que seu médico saiba se você está tomando digoxina, anticoncepcionais orais, metformina23 ou quaisquer outras drogas antiepilépticas, como fenitoína e carbamazepina. Você também deve informá-lo caso ingira bebidas alcoólicas ou esteja tomando drogas que diminuem a atividade do sistema nervoso24 (depressores do sistema nervoso central25), por exemplo, anti-histamínicos, remédios contra insônia, antidepressivos, calmantes, narcóticos, barbitúricos ou analgésicos26.
Contra-indicações, Precauções e Advertências
Atenção: este medicamento contém açúcar3, portanto, deve ser usado com cautela em portadores de diabetes27.
Informe seu médico sobre qualquer medicamento que esteja usando, antes do início ou durante o tratamento. Avise seu médico sobre problemas de saúde8 ou alergias que você tem ou teve no passado. Você não deve tomar Topamax® se você for alérgico a qualquer ingrediente do produto. Informe ao seu médico se você tem ou teve pedras nos rins12. Ele deverá recomendar que você ingira muito líquido enquanto estiver se tratando com Topamax® . Informe seu médico se você apresentar problemas de visão17 e/ou dor nos olhos28.
Efeito sobre a capacidade de dirigir e operar máquinas
Topamax® pode causar diminuição da atenção em algumas pessoas. Certifique-se de que o medicamento não altera seu estado de alerta antes de você dirigir, operar máquinas ou executar tarefas que podem ser perigosas, caso você não esteja atento.
NÃO TOME REMÉDIO SEM O CONHECIMENTO DO SEU MÉDICO. PODE SER PERIGOSO PARA A SAÚDE8.
Informações Técnicas aos Profissionais de Saúde8
Comprimidos / Cápsulas
topiramato
Formas Farmacêuticas e apresentações
Comprimidos:
Comprimidos revestidos de 25 mg em embalagens com 60 comprimidos.
Comprimidos revestidos de 50 mg em embalagens com 60 comprimidos.
Comprimidos revestidos de 100 mg em embalagens com 60 comprimidos.
Cápsulas:
Cápsulas de 15 mg e 25 mg em embalagem com 60 cápsulas.
Uso adulto e pediátrico
Informações Gerais
Marca Comercial: Topamax®
Princípio Ativo: topiramato
Classe Terapêutica1: Anticonvulsionantes
Composição
Cada comprimido revestido de 25 mg contém:
topiramato ........................................... 25 mg
Excipientes: amido de milho, amidoglicolato de sódio, celulose microcristalina, cera de carnaúba, estearato de magnésio, lactose2 e opadry branco.
Cada comprimido revestido de 50 mg contém:
topiramato ........................................... 50 mg
Excipientes: amido de milho, amidoglicolato de sódio, celulose microcristalina, cera de carnaúba, estearato de magnésio, lactose2 e opadry amarelo claro.
Cada comprimido revestido de 100 mg contém:
topiramato .......................................... 100 mg
Excipientes: amido de milho, amidoglicolato de sódio, celulose microcristalina, cera de carnaúba, estearato de magnésio, lactose2 e opadry amarelo.
Cada cápsula de 15 mg contém:
topiramato ........................................... 15 mg
Excipientes: acetato de celulose, esferas de açúcar3 e povidona.
Externamente (cápsula): dióxido de titânio e gelatina.
Cada cápsula de 25 mg contém:
topiramato ........................................... 25 mg
Excipientes: acetato de celulose, esferas de açúcar3 e povidona.
Externamente (cápsula): dióxido de titânio e gelatina.
Caracterêsticas Farmacolígicas
Propriedades Farmacodinâmicas
O topiramato é classificado como monossacarídeo sulfamato-substituído. Estudos eletrofisiológicos e bioquímicos em cultura de neurônios29 identificaram três propriedades que podem contribuir para a eficácia antiepiléptica do topiramato. Potenciais de ação provocados repetidamente pela despolarização contínua de neurônios29 foram bloqueados temporariamente pelo topiramato, sugerindo uma modulação de canais de sódio dependentes de voltagem. O topiramato aumenta a freqüência com que o ácido gama-aminobutírico (GABA30) ativa receptores GABAA e aumenta a capacidade do GABA30 de induzir o influxo de íons31 cloreto, sugerindo que o topiramato potencializa a atividade desse neurotransmissor inibitório.
Este efeito não foi bloqueado pelo flumazenil, um antagonista32 benzodiazepínico e o topiramato não aumentou a duração da abertura do canal, o que o diferencia de barbitúricos que modulam receptores GABAA.
Como o perfil antiepiléptico do topiramato difere acentuadamente do das benzodiazepinas, ele pode modular um subtipo do receptor GABAA insensível à benzodiazepina. O topiramato antagoniza a capacidade do cainato ativar o subtipo AMPA/cainato (ácido α-amino-3-hidroxi-5-metilisoxazol-4-propiônico) do receptor aminoácido excitatório (glutamato), mas não exerce nenhum efeito aparente na atividade do N-metil-D-aspartato (NMDA) no subtipo de receptor NMDA. Estes efeitos do topiramato são dependentes da concentração, em uma faixa de 1 µM a 200 µM, com atividade mínima observada entre 1µM e 10 µM.
Além disso, o topiramato inibe algumas isoenzimas da anidrase carbônica. Este efeito farmacológico é muito mais fraco do que o da acetazolamida, um conhecido inibidor da anidrase carbônica, e não é considerado um componente importante da atividade antiepiléptica do topiramato.
Em estudos experimentais, o topiramato apresenta atividade anticonvulsivante em ratos e camundongos, em crises induzidas por eletrochoque máximo, e é eficaz em modelos de epilepsia4 em roedores, que incluem crises tônicas e crises semelhantes a crises de ausência, em ratos com epilepsia4 espontânea, e crises tônico-clônicas induzidas em ratos por abrasamento da amígdala33 ou isquemia34 global. O topiramato é apenas discretamente eficaz no bloqueio de crises clônicas induzidas pelo pentilenotetrazol, um antagonista32 de receptor GABAA.
Estudos realizados em camundongos submetidos à administração concomitante de topiramato e carbamazepina ou fenobarbital demonstraram atividade anticonvulsivante sinérgica, enquanto que a associação com fenitoína mostrou atividade anticonvulsivante aditiva. Em estudos clínicos bem controlados de uso adjuvante, não foi verificada nenhuma correlação entre concentrações plasmáticas de vale do topiramato e sua eficácia clínica. Não há evidência de tolerância em humanos.
Estudos clínicos em epilepsia4
Os resultados de experimentações clínicas controladas estabeleceram a eficácia de Topamax® comprimidos (topiramato) e Topamax® cápsulas (cápsulas de topiramato) como monoterapia para adultos e crianças (de 6 anos de idade ou mais velhos) com epilepsia4, terapia adjuntiva em adultos e pacientes pediátricos de 2 a 16 anos com crises epilépticas parciais e crises convulsivas tônico-clônicas generalizadas primárias, e nos pacientes com 2 anos de idade e mais velhos com crises associadas com a Síndrome35 de Lennox-Gastaut.
Monoterapia
A efetividade do topiramato como monoterapia em adultos e em crianças de 6 anos de idade e mais velhos com epilepsia4 recentemente diagnosticada foi estabelecida em 4 estudos randomizados, duplo-cego e paralelos. O estudo EPMN-106 foi conduzido em 487 pacientes (6 a 83 anos de idade) que tiveram um diagnóstico36 novo de epilepsia4 (de início parcial ou generalizado) ou um diagnóstico36 de epilepsia4 recorrente enquanto não estavam fazendo uso de drogas antiepiléticas (AEDs). Os pacientes foram randomizados para receber o topiramato 50 mg/dia ou o topiramato 400 mg/dia. Os pacientes permaneceram na fase duplo-cego até apresentarem a primeira crise parcial ou crise tônico-clônica generalizada, até o término da fase de duplo-cego 6 meses após a randomização do último sujeito, ou até a retirada por razões específicas do protocolo. A avaliação primária de eficácia foi baseada na comparação entre grupos de dose do topiramato com respeito ao tempo para a primeira crise parcial ou crise generalizada tônico-clônica durante a fase duplo-cego. A comparação das curvas da sobrevivência37 de Kaplan-Meier do tempo para a primeira crise favoreceu a topiramato 400 mg/dia sobre o topiramato 50 mg/dia (p=0,0002, teste log-rank). A separação entre os grupos em favor do grupo de maior dose ocorreu precocemente na fase de titulação e foi estatisticamente significativa tão precocemente quanto duas semanas pós-randomização (p = 0,046), quando, seguindo a programação semanal de titulação, os sujeitos no grupo de maior dose alcançaram uma dose máxima do topiramato de 100 mg/dia. O grupo de maior dose também foi superior ao do grupo com menor dose com respeito à proporção dos sujeitos que remanesceram sem crise convulsiva, baseado nas estimativas de Kaplan-Meier, para um mínimo de 6 meses da terapia (82,9% contra 71,4%; p = 0,005), e para um mínimo de 1 ano da terapia (75,7% contra 58,8%; p = 0,001). A relação de taxas de falha por tempo até a primeira crise convulsiva foi 0,516 (intervalo de confiança de 95%, 0,364 a 0,733). Os efeitos do tratamento com respeito ao tempo até a primeira crise convulsiva foram consistentes através dos vários subgrupos definidos pela idade, sexo, região geográfica, peso corpóreo basal, tipo de crise convulsiva basal, tempo desde o diagnóstico36, e uso de anticoncepcionais basais.
No estudo YI, estudo de centro único, pacientes com idades de15-63 anos com crise convulsiva refratária parcial (n=48) foram convertidos de seu tratamento prévio para monoterapia com Topamax® 100 mg/dia ou 1000 mg/dia. O grupo de alta dose foi estatisticamente superior ao grupo de menor dose para as variáveis de eficácia. 54% dos pacientes de alta dose conseguiram monoterapia comparado à 17% do grupo de baixa dose com a diferença entre as doses sendo estatisticamente significativa (p=0,005). O tempo médio de retirada foi significativamente maior no grupo de alta dose (p=0,002). As avaliações globais do investigador e do sujeito da resposta clínica favoreceram estatisticamente o grupo de alta dose (≤ 0,002).
No estudo EPMN-104, pacientes adultos e pediátricos (de idades 6-85 anos) com epilepsia4 recentemente diagnosticada (n=252) foram randomizados em grupos de baixas-doses (25 ou 50 mg/dia) ou altas doses (200 ou 500 mg/dia) baseado em seu peso corpóreo. No geral, 54% dos pacientes do grupo de alta dose e 39% dos pacientes de baixa dose relataram estar sem crise convulsiva durante a fase duplo-cego (p=0,022). O grupo de alta dose também foi superior ao grupo de baixa dose com respeito à distribuição de freqüência das crises convulsivas (p=0,008) e à diferença no tempo até a primeira crise convulsiva através de três concentrações plasmáticas estratificadas do topiramato (p=0,015).
No estudo EPMN-105, os pacientes com idade de 6-84 anos com epilepsia4 recentemente diagnosticada (n=613) foram randomizados para receber 100 ou 200 mg/dia de Topamax® ou do tratamento antiepiléptico padrão (carbamazepina ou valproato). Topamax® foi tão eficaz quanto a carbamazepina ou o valproato na redução das crises convulsivas nestes pacientes; o intervalo de confiança de 95% para a diferença entre os dois grupos do tratamento foram estreitos e incluíram zero, indicando que não houve diferença estatisticamente significativa entre os grupos. Os dois grupos de tratamento foram também comparáveis em relação a toda utilidade clínica e desfechos de eficácia incluindo tempo de retirada, proporção de indivíduos livres de crises convulsivas e tempo até a primeira crise convulsiva.
Pacientes (n=207; 32 com idade ≤ 16 anos) que completaram a fase duplo-cego do estudo YI e EPMN-104 foram inseridos na extensão à longo prazo do estudo com a maioria dos pacientes recebendo Topamax® por 2 a 5 anos. Nestes estudos, a eficácia mantida foi demonstrada com administração à longo prazo de Topamax® como monoterapia. Não houve mudança significativa na dose durante o período de extensão e nenhuma indicação que a efetividade da monoterapia de Topamax® diminuiu com exposição continuada.
Terapia Adjuntiva
Estudo controlado em pacientes com Crises Convulsivas de Início Parcial.
Os adultos com Crises Convulsivas de Início Parcial
A eficácia do topiramato como um tratamento adjuntivo para adultos com Crises Convulsivas de Início Parcial foi estabelecida em seis estudos multicêntricos, randomizados, duplo-cegos, controlados por placebo38, dois comparando diversas dosagens do topiramato e do placebo38 e quatro comparando uma única dosagem com placebo38 em pacientes com um histórico de Crises Convulsivas de Início Parcial, com ou sem generalização secundária dessas crises.
Foi permitido aos pacientes destes estudos um máximo de duas drogas antiepilépticas (AEDs) em adição às cápsulas de Topamax® ou placebo38. Em cada estudo, os pacientes foram estabilizados em dosagens ótimas de seus concomitantes AEDs durante a fase basal que durou entre 4 e 12 semanas. Os pacientes que experimentaram um número mínimo pré-especificado de Crises Convulsivas de Início Parcial, com ou sem generalização secundária, durante a fase basal (12 apreensões para a fase 12-semanas, 8 para a fase basal 8-semanas, ou 3 para a fase basal de 4-semanas) foram atribuídos de forma randomizada ao placebo38 ou a uma dose específica de Topamax® cápsulas além do seu outro antiepiléptico.
Após a randomização, os pacientes começaram a fase duplo-cego do tratamento. Em cinco dos seis estudos, os pacientes receberam a droga ativa começando com 100 mg por dia; a dose foi então aumentada por incrementos de 100 ou 200 mg/dia semanalmente ou semanas alternadas até que a dose determinada fosse atingida, a menos que a intolerância impedisse os aumentos. No sexto estudo (119), os 25 ou 50 mg/dia de doses iniciais do topiramato foram seguidas por aumentos semanais respectivos de 25 ou 50 mg/dia até que a dose alvo de 200 mg/dia fosse atingida. Após a titulação, os pacientes entraram no período de 4, 8, ou 12-semanas de estabilização. Os números de pacientes randomizados para cada dose, e as doses medianas e médias reais de estabilização são mostradas na Tabela 1.
Pacientes Pediátricos com idade de 2-16 anos com Crises Convulsivas de Início Parcial
A efetividade do topiramato enquanto um tratamento adjuntivo para pacientes11 pediátricos de 2-16 anos com Crises Convulsivas de Início Parcial foram estabelecidos em um estudo multicêntrico, randomizado39, duplo-cego, contolado por placebo38, comparando topiramato e o placebo38 nos pacientes com uma historia de Crises Convulsivas de Início Parcial com ou sem generalização secundária dessas crises.
Foi permitido aos pacientes destes estudos um máximo de duas drogas antiepilépticas (AEDs) além das cápsulas de Topamax® ou placebo38. Neste estudo, os pacientes foram estabilizados em dosagens ótimas de seus antiepilépticos concomitantes durante a fase basal de 8 semanas. Os pacientes que experimentaram ao menos seis Crises Convulsivas de Início Parcial, com ou sem generalização secundária, durante a fase basal foram atribuídos de forma randomizada ao placebo38 ou Topamax® comprimidos em adição ao seu outro AEDs.
Após a randomização, os pacientes começaram a fase duplo-cego do tratamento. Os pacientes receberam a droga ativa começando com 25 ou 50 mg por dia; a dose foi então aumentada em 25 a 150 mg/dia em semanas alternadas até que a dose de 125, 175, 225 ou 400 mg/dia baseada no peso do paciente e aproximada a uma dose de 6 mg/Kg fosse atingida, a menos que a intolerância impedisse os aumentos. Após a titulação, os pacientes entraram no período de 8-semanas de estabilização.
Estudo controlado em pacientes com Crise Convulsiva Tônico-Clônica Generalizada Primária
A eficácia do topiramato como um tratamento adjuntivo para Crise Convulsiva Tônico-Clônica Generalizada Primária nos pacientes de 2 anos de idade ou mais velhos foi estabelecida em um estudo multicêntrico, randomizado39, duplo-cego, controlado por placebo38, comparando uma única dosagem do topiramato e do placebo38.
Foi permitido aos pacientes destes estudos um máximo de duas drogas antiepilépticas (AEDs) além do Topamax® ou placebo38. Neste estudo, os pacientes foram estabilizados em dosagens ótimas de seus antiepilépticos concomitantes durante uma fase de 8 semanas. Os pacientes que experimentaram pelo menos três Crise Convulsiva Tônico-Clônica Generalizada Primária durante a fase basal foram atribuídos de forma randomizada ao placebo38 ou Topamax® cápsulas além do seu outro AEDs.
Após a randomização, os pacientes começaram a fase duplo-cego do tratamento. Os pacientes receberam a droga ativa começando com 50 mg por dia por quatro semanas; a dose foi então aumentada em 50 a 150 mg/dia em semanas alternadas até que a dose de 175, 225 ou 400 mg/dia baseada no peso do paciente e aproximada a uma dose de 6 mg/Kg fosse atingida, a menos que a intolerância impedisse os aumentos. Após a titulação, os pacientes entraram no período de 12-semanas de estabilização.
Estudos controlados em pacientes com Síndrome35 de Lennox-Gastaut
A eficácia do topiramato como um tratamento adjuntivo para crises associadas com a Síndrome35 de Lennox-Gastaut foi estabelecida em um estudo multicêntrico, randomizado39, duplo-cego, controladas por placebo38, comparando uma única dosagem do topiramato com o placebo38 em pacientes de dois anos de idade ou mais velhos.
Foi permitido aos pacientes destes estudos um máximo de duas drogas antiepilépticas (AEDs) além das cápsulas de Topamax® ou placebo38. Pacientes que haviam apresentado pelo menos 60 crises por mês antes de iniciarem o estudo foram estabilizados em dosagens ótimas de seus concomitantes AEDs durante a fase basal de quatro semanas. Acabando a fase basal, os pacientes foram atribuídos de forma randomizada ao placebo38 ou Topamax® cápsulas além do seu outro AEDs.
A droga ativa foi titulada começando a 1 mg/Kg por dia por semana; a dose foi então aumentada por incrementos de 3 mg/dia por uma semana e depois de 6 mg/Kg por dia. Após a titulação, os pacientes entraram no período de 8-semanas de estabilização. As medidas preliminares de efetividade foram a redução da porcentagem de drop attack e uma avaliação global parental da severidade da crise convulsiva.
Em todos os estudos add-on, foi medida a redução na taxa de crise convulsiva da condição basal durante a fase duplo-cego. As reduções percentuais medianas nas taxas de crise convulsiva e nas taxas de respondedores (fração dos pacientes com ao menos uma redução de 50%) por grupo de tratamento para cada estudo são mostradas abaixo na Tabela 1. Como descrito acima, uma melhora global na severidade da crise convulsiva foi avaliada também na experimentação de Lennox-Gastaut.
Tabela 1: Resultados de Eficácia em estudo duplo-cego40, placebo38-controlado, add-on de crises epilépticas
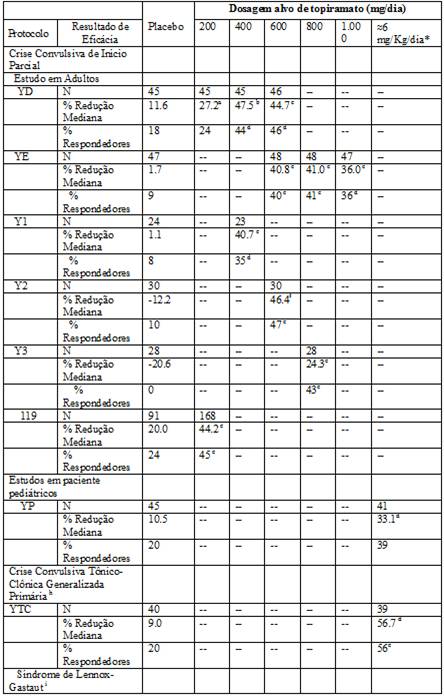
Comparação com o placebo38: a p=0.080; b p≤0.010; c p≤0.001; d p≤0.050; e p=0.065; f p≤0.005; g p=0.071;
h % Redução Mediana e % respondedores são relatadas por Crise Convulsiva Tônico-Clônica Generalizada;
i % Redução Mediana e % respondedores são relatadas para drop attack, i.e., crise tônica ou atônica;
j Porcentagem de indivíduos que apresentaram melhora mínima, muita ou muito melhor a partir da linha de base
* Para os protocolos YP e o YTC, dosagens alvo especificadas no protocolo (<9,3 mg/Kg/dia) foram baseados no peso do indivíduo para aproximar a de 6 mg/Kg por dia, esta dosagem corresponde à dosagem em mg/dia de 125, 175, 225, e 400 mg/dia.
As análises do subconjunto da eficácia antiepiléptica do Topamax® nestes estudos não mostraram diferença em função do gênero, raça, idade, taxa basal de crise convulsiva, ou do antiepiléptico concomitante.
Estudos clínicos em enxaqueca5
O programa de desenvolvimento clínico para avaliar a eficácia de Topamax® na profilaxia da enxaqueca5 incluiu dois estudos multicêntricos, randomizados, duplo-cegos, controlados por placebo38, de grupos paralelos conduzidos na América do Norte (MIGR-001 e MIGR-002). O desfecho primário de eficácia foi a redução de freqüência de cefaléias41 na enxaqueca5, medida pela mudança em 4 semanas da porcentagem de enxaqueca5 da fase basal para a fase de tratamento duplo-cego em cada grupo de tratamento com Topamax® comparado ao placebo38 na população com intenção de tratamento (ITT).
Os resultados conjuntos dos dois estudos pivotais para avaliar doses de Topamax® 50 (N=233), 100 (N=244) e 200 mg/dia (N=228), mostraram uma redução percentual média no período de enxaqueca5 mensalmente medido de 35%, 51% e 49%, respectivamente, comparado a 21% para o grupo placebo38 (N=229). As doses de 100 e 200 mg/dia de Topamax® foram estatisticamente melhores do que o placebo38. De maneira especial, 27% dos pacientes que receberam Topamax® 100 mg/dia atingiram uma redução de pelo menos 75% na freqüência de enxaquecas42, enquanto que 52% atingiram pelo menos 50% de redução.
Um estudo adicional de suporte, MIGR-003, demonstrou que Topamax® 100 mg/dia foi comparável em termos de eficácia ao propranolol 160 mg/dia. Não houve diferenças estatisticamente significantes entre os dois grupos no desfecho primário de eficácia.
Propriedades Farmacocinéticas
As formulações em comprimido e cápsula são bioequivalentes.
Em comparação a outras drogas antiepilépticas, o topiramato apresenta uma meia-vida plasmática longa, farmacocinética linear, depuração plasmática predominantemente renal43, ausência de ligação significante a proteínas44 plasmáticas e de metabólitos45 ativos significantes.
O topiramato não é um indutor potente de enzimas relacionadas à biotransformação de fármacos, pode ser administrado com ou sem alimentos e não requer monitorização de níveis plasmáticos. Em ensaios clínicos46, não houve relação consistente entre concentrações plasmáticas e eficácia ou eventos adversos.
O topiramato é rapidamente e bem absorvido. Após a administração oral de 100 mg de topiramato a voluntários sadios, o pico médio de concentração plasmática (Cmáx) foi de 1,5 µg/mL, obtido num período de 2 a 3 horas (Tmáx). Com base na recuperação da radioatividade na urina21, a extensão média de absorção de uma dose oral de 100 mg de topiramato marcado com 14C foi de, no mínimo, 81%. A biodisponibilidade do topiramato não é afetada de forma clinicamente significante pela ingestão de alimentos. A ligação à proteínas44 plasmáticas é, em geral, de 13 a 17%. Observa-se baixa capacidade de ligação do topiramato aos eritrócitos47, saturável em concentrações plasmáticas acima de 4 *g/mL. O volume de distribuição variou de forma inversamente proporcional à dose. A média do volume de distribuição aparente foi de 0,80 a 0,55 L/Kg, para uma única dose entre 100 a 1.200 mg. Um efeito do gênero sobre o volume de distribuição foi detectado, com valores em mulheres cerca de 50% dos obtidos em homens. Esta diferença foi atribuída à maior porcentagem de gordura48 corpórea em pacientes do sexo feminino, sem conseqüência clínica.
Em voluntários sadios, o topiramato não sofre biotransformação extensa (aproximadamente 20%). É biotransformado em até 50% em uso adjuvante com indutores reconhecidos de enzimas relacionadas à biotransformação de fármacos. Seis metabólitos45, formados por hidroxilação, hidrólise e glucuronidação, foram identificados, caracterizados e isolados no plasma49, urina21 e fezes. Cada metabólito50 representa menos de 3% da radioatividade total excretada após a administração do topiramato marcado com 14C. Dois metabólitos45, que conservam a maior parte da estrutura química do topiramato, foram testados e apresentaram pouca ou nenhuma atividade anticonvulsivante.
Em humanos, a principal via de eliminação do topiramato inalterado e de seus metabólitos45 é a renal43 (no mínimo 81% da dose).
Aproximadamente 66% de uma dose de topiramato marcado com 14C foi excretada inalterada na urina21, em quatro dias. Após a administração de doses de 50 mg e 100 mg de topiramato, duas vezes ao dia, a depuração renal43 média foi de aproximadamente 18 mL/min e 17 mL/min, respectivamente. Há evidência de reabsorção tubular renal43 do topiramato. Este achado é comprovado por estudos conduzidos em ratos, onde o topiramato associado à probenecida, tendo sido observado um aumento significante da depuração renal43 do topiramato.
De modo geral, a depuração plasmática do topiramato em humanos é de aproximadamente 20 a 30 mL/min, após a administração oral.
O topiramato apresenta baixa variação interindividual nas concentrações plasmáticas e, portanto, apresenta farmacocinética previsível. A farmacocinética do topiramato é linear, com a depuração plasmática permanecendo constante e a área sob a curva de concentração plasmática aumentando de modo proporcional a doses orais, em uma faixa posológica de 100 a 400 mg, em voluntários sadios. Pacientes com função renal43 normal podem levar 4 a 8 dias para atingir as concentrações plasmáticas do estado de equilíbrio. Após a administração de doses orais múltiplas de 100 mg, duas vezes ao dia, a voluntários sadios, a Cmáx média foi de 6,76 mcg/mL. A meia-vida de eliminação plasmática após a administração de doses múltiplas de 50 mg e 100 mg, duas vezes ao dia, foi de aproximadamente 21 horas.
O uso adjuvante de topiramato, em doses múltiplas de 100 a 400 mg, duas vezes por dia, com fenitoína ou carbamazepina, produz aumentos proporcionais à dose nas concentrações plasmáticas do topiramato.
A depuração plasmática e renal43 do topiramato é reduzida em pacientes com insuficiência renal51 (CLCR ≤ 60 mL/min). Em pacientes com doença renal43 grave, a depuração plasmática apresentou-se reduzida. Como resultado, concentrações plasmáticas de equilíbrio mais elevadas são esperadas para uma determinada dose de topiramato administrada, em pacientes com insuficiência renal51, em comparação às obtidas em pacientes com função renal43 normal. O topiramato pode ser removido do plasma49, com eficácia, por hemodiálise52.
A depuração plasmática do topiramato permanece inalterada em indivíduos idosos, na ausência de doença renal43 subjacente.
A depuração plasmática do topiramato é reduzida em pacientes com insuficiência hepática53 moderada ou grave.
Farmacocinética em crianças de até 12 anos de idade
A farmacocinética do topiramato em uso adjuvante é linear em crianças, como em adultos, com taxa de depuração independente da dose e concentrações plasmáticas de equilíbrio com aumentos proporcionais à dose. No entanto, crianças têm depuração mais elevada e meia-vida de eliminação mais curta. Consequentemente, concentrações plasmáticas de topiramato para a mesma dose em mg/Kg podem ser menores em crianças comparadas às obtidas em adultos. Assim como em adultos, drogas antiepilépticas indutoras de enzimas hepáticas54 diminuem as concentrações plasmáticas do estado de equilíbrio.
Indicações
Topamax® é indicado em monoterapia tanto em pacientes com epilepsia4 recentemente diagnosticada como em pacientes que recebiam terapia adjuvante e serão convertidos à monoterapia.
Topamax® é indicado, para adultos e crianças, como adjuvante no tratamento de crises epilépticas parciais, com ou sem generalização secundária e crises tônico-clônicas generalizadas primárias.
Topamax® é indicado, também, para adultos e crianças como tratamento adjuvante das crises associadas à Síndrome35 de Lennox-Gastaut.
Topamax® é indicado, em adultos, como tratamento profilático da enxaqueca5. O uso de Topamax® para o tratamento agudo55 da enxaqueca5 não foi estudado.
Contra Indicações
Hipersensibilidade ao topiramato ou a qualquer componente da fórmula do produto. Não deve ser administrado durante a gravidez9.
Posologia
Para o controle ideal, tanto em adultos como em crianças, recomenda-se iniciar o tratamento, com uma dose baixa, seguida de titulação até uma dose eficaz.
Topamax® está disponível em comprimidos e em uma formulação em cápsulas com microgrânulos revestidos. Recomenda-se não partir os comprimidos. A formulação em cápsulas é especialmente indicada para os pacientes com dificuldade de deglutição56, como crianças e idosos.
As cápsulas de Topamax® podem ser ingeridas inteiras ou podem ser abertas e seu conteúdo total ser administrado espalhado em uma pequena quantidade (colher de chá) de alimento pastoso. A mistura alimento/medicamento deve ser ingerida imediatamente, sem mastigar e não deve ser guardada para uso posterior.
Não é necessário monitorar as concentrações plasmáticas de topiramato para otimizar o tratamento com Topamax® . Raramente, o tratamento concomitante com fenitoína poderá exigir o ajuste de dose da fenitoína para que resultados clínicos ótimos sejam alcançados. A adição ou retirada da fenitoína e da carbamazepina do tratamento coadjuvante57 com Topamax® poderá exigir o ajuste da dose do Topamax® . Topamax® pode ser administrado com ou sem alimentos.
Tratamento Adjuvante em Epilepsia4 de Topamax
Adultos A dose mínima eficaz é 200 mg ao dia. Em geral, a dose total diária varia de 200 mg a 400 mg, dividida em duas tomadas. Alguns pacientes eventualmente poderão necessitar de doses de até 1600 mg por dia, que é a dose máxima. Recomenda-se que o tratamento seja iniciado com uma dose baixa, seguida por uma titulação da dose até que se chegue à dose adequada.O tratamento deve ser iniciado com 25-50 mg, administrados à noite, durante uma semana. Posteriormente, a intervalos de 1 ou 2 semanas, a dose deverá ser aumentada de 25 a 50 mg/dia e dividida em duas tomadas. A titulação da dose deverá ser orientada pelos resultados clínicos. Alguns pacientes poderão obter eficácia com uma dose única diária.
Essas recomendações posológicas se aplicam a todos os pacientes adultos, incluindo idosos, desde que não haja doença renal43 subjacente. Porém, nos pacientes sob tratamento com hemodiálise52, há necessidade de uma dose suplementar. Como Topamax® é removido do plasma49 por hemodiálise52, uma dose complementar igual a aproximadamente metade da dose diária deverá ser administrada nos dias de hemodiálise52. Esta dose complementar deverá ser dividida em duas tomadas, ao início e ao término da hemodiálise52. A dose suplementar poderá ser ajustada dependendo das características do equipamento de diálise58 que estiver sendo utilizado.
Crianças acima de 2 anos de idade
A dose total diária de Topamax® recomendada para crianças é de 5 a 9 mg/Kg/dia, dividida em duas tomadas. A titulação deve ser iniciada com 25 mg (ou menos, baseado na faixa de 1 a 3 mg/Kg/dia) administrados à noite, durante a primeira semana. Posteriormente, a dose deve ser aumentada em 1 a 3 mg/Kg/dia (dividida em duas tomadas), à intervalos de 1 ou 2 semanas, até alcançar uma resposta clínica ótima. A titulação de dose deve ser orientada pela resposta clínica.
Doses diárias de até 30 mg/Kg/dia foram bem toleradas nos estudos realizados.
Monoterapia em Epilepsia4 de Topamax
Quando drogas antiepilépticas concomitantes são retiradas a fim de manter o tratamento com topiramato em monoterapia, deve-se considerar os efeitos que isto pode ter sobre o controle das crises. Exceto por razões de segurança que exijam uma retirada abrupta das outras drogas antiepilépticas, recomenda-se a descontinuação gradual com redução de aproximadamente um terço da dose a cada 2 semanas.Quando fármacos indutores enzimáticos são retirados, os níveis plasmáticos de topiramato irão aumentar. Uma diminuição da dose de Topamax® pode ser necessária, se for clinicamente indicado.
Adultos
A titulação da dose deve ser iniciada com 25 mg, administrado à noite, por uma semana. Então, a dose deve ser aumentada em 25 ou 50 mg ao dia, a intervalos de 1 ou 2 semanas, dividida em duas tomadas. Se o paciente for incapaz de tolerar o esquema de titulação, aumentos menores ou intervalos mais longos entre os aumentos da dose podem ser usados. A dose e a velocidade de titulação devem ser orientadas pelo resultado clínico.
Em adultos, a dose alvo inicial recomendada para o topiramato em monoterapia é de 100 mg/dia e a dose diária máxima recomendada é 500 mg. Alguns pacientes com formas refratárias59 de epilepsia4 toleraram doses de 1000 mg/dia de topiramato em monoterapia. Estas recomendações aplicam-se a todos os adultos, incluindo idosos sem doença renal43 subjacente.
Crianças
Em crianças acima de 2 anos de idade a dose inicial varia de 0,5 a 1 mg/Kg, à noite, durante uma semana. A seguir a dose deve ser aumentada em 0,5 a 1 mg/Kg/dia à intervalos de 1 a 2 semanas, dividida em duas tomadas. Se a criança for incapaz de tolerar o esquema de titulação da dose, aumentos menores ou intervalos maiores entre os aumentos da dose podem ser usados. A dose e a velocidade da titulação devem ser orientadas pelo resultado clínico.
A dose-alvo inicial recomendada para o topiramato em monoterapia em crianças é de 3 a 6 mg/Kg/dia. Crianças com crises de início parcial de diagnóstico36 recente receberam doses de até 500 mg/dia.
Enxaqueca5 de Topamax
O tratamento deve ser iniciado com 25 mg à noite durante 1 semana. A dose deve então ser aumentada em 25 mg/dia, uma vez por semana. Se o paciente for incapaz de tolerar o esquema de gradação, intervalos maiores entre os ajustes de dose podem ser usados. A dose total diária de topiramato recomendada na profilaxia de enxaqueca5 é 100 mg/dia, divididos em duas tomadas. Alguns pacientes podem se beneficiar de uma dose diária total de 50 mg. Pacientes receberam dose diária total de até 200 mg/dia. A dose e a velocidade de gradação devem ser orientadas pelo resultado clínico.Advertências
Atenção: este medicamento contém açúcar3, portanto, deve ser usado com cautela em portadores de diabetes27.
Nos pacientes com ou sem histórico de crises epilépticas ou epilepsia4, as drogas antiepilépticas incluindo o Topamax® devem ser gradativamente descontinuadas, para minimizar a possibilidade de crises epilépticas ou aumento da freqüência de crises epilépticas.
Em estudos clínicos, as doses diárias foram diminuídas de 50-100 mg nos adultos com epilepsia4 e 25-50 mg em adultos recebendo Topamax® em intervalos semanais a doses de até 100 mg/dia para a profilaxia da enxaqueca5. Em estudos clínicos em crianças, Topamax® foi retirado gradualmente por um período de 2-8 semanas. Nas situações onde a retirada rápida de Topamax® é de recomendação médica, é recomendada monitoração apropriada.
A principal via de eliminação do topiramato e seus metabólitos45 é através dos rins12. A eliminação pelos rins12 é dependente da função renal43 e independe da idade. Pacientes com insuficiência renal51 moderada ou grave podem levar de 10 a 15 dias para atingir as concentrações plasmáticas no estado de equilíbrio, em comparação com o período de 4 a 8 dias, observado em pacientes com função renal43 normal.
Em todos os pacientes, a titulação da dose deverá ser orientado pelo resultado clínico (isto é, controle das crises, evitando efeitos colaterais13), considerando-se que indivíduos sabidamente portadores de insuficiência renal51 poderão precisar de um tempo mais longo para alcançar o estado de equilíbrio, a cada dose.
Hidratação adequada durante o uso de topiramato é muito importante. Hidratação pode reduzir o risco de nefrolitíase. Hidratação apropriada antes e durante atividades como exercícios físicos ou exposição a temperaturas elevadas pode reduzir o risco de eventos adversos relacionados ao calor.
Transtornos do humor / Depressão
Um aumento na incidência60 de transtornos do humor e depressão tem sido observados durante o tratamento com topiramato.
Ideação suicida
Fármacos antiepilépticos, inclusive Topamax® , aumentam o risco de pensamentos ou comportamento suicidas em pacientes que utilizam estes fármacos para qualquer indicação. Uma meta-análise de estudo randomizado61 placebo38 controlado com medicamentos antiepilépticos mostrou um aumento do risco de ideação e comportamento suicida (0,43% em medicamentos antiepilépticos versus 0,24% com placebo38). O mecanismo de ação para este risco não é conhecido.
Em estudo clínico duplo-cego, eventos relacionados ao suicídio (ideação suicida, tentativa de suicídio) ocorreu com freqüência de 0,5% nos pacientes tratados com topiramato (46 dos 8652 pacientes tratados) comparado com 0,2% dos indivíduos tratados com placebo38. Um caso de suicídio foi relatado em paciente tratado com Topamax® para transtorno bipolar.
Pacientes devem ser monitorados para os sinais14 de ideação e comportamento suicida e tratamento apropriado deve ser considerado. Pacientes (e quando apropriado os cuidadores do paciente) devem ser avisados a procurar imediatamente cuidado médico quando aparecerem sintomas15 de ideação ou comportamento suicida.
Nefrolitíase
Alguns pacientes, especialmente aqueles com predisposição à nefrolitíase, podem ter risco aumentado de formação de cálculo62 renal43 e sinais14 e sintomas15 associados, tais como cólica renal43, dor renal43 e dor em flanco63.
Fatores de risco de nefrolitíase incluem antecedentes de cálculo62 renal43, histórico familiar de nefrolitíase e hipercalciúria64. Nenhum desses fatores de risco pode antecipar com certeza a formação de cálculo62 durante tratamento com topiramato. Além disso, pacientes utilizando outros medicamentos associados à possibilidade de ocorrência de nefrolitíase podem ter um risco aumentado.
Função hepática65 diminuída
Topamax® deve ser administrado com cuidado em pacientes com insuficiência hepática53, uma vez que o “clearance” do topiramato pode estar reduzido neste grupo de pacientes.
Miopia66 aguda e glaucoma67 agudo55 de ângulo fechado secundário
Uma síndrome35 consistindo de miopia66 aguda e glaucoma67 agudo55 de ângulo fechado secundário tem sido relatada em pacientes em uso de Topamax® . Os sintomas15 incluem início agudo55 de redução da acuidade visual68 e/ou dor ocular. Achados oftalmológicos podem incluir miopia66, redução da câmara anterior69, hiperemia70 ocular (vermelhidão) e aumento da pressão intraocular71. Midríase72 pode ou não estar presente. Esta síndrome35 pode estar associada com efusão73 supraciliar resultando no deslocamento do cristalino74 e da íris75, com glaucoma67 agudo55 de ângulo fechado secundário. Os sintomas15 ocorrem, caracteristicamente, no primeiro mês após do início do tratamento com Topamax® . Ao contrário do glaucoma67 de ângulo fechado primário, que é raro em pessoas com menos de 40 anos, o glaucoma67 agudo55 de ângulo fechado secundário associado com topiramato tem sido relatado tanto em pacientes pediátricos como adultos. O tratamento inclui a interrupção do Topamax® , o mais rápido possível de acordo com a avaliação do médico, e medidas apropriadas para reduzir a pressão intraocular71. Estas medidas geralmente resultam na redução da pressão intraocular71.
Elevada pressão intraocular71 de qualquer etiologia76, se não for tratada, pode acarretar em graves sequelas77, incluindo perda permanente da visão17
Acidose metabólica78
Hipercloremia, hiato não-aniônico, acidose metabólica78 (isto é, redução do bicarbonato sérico abaixo do intervalo de referência normal na ausência de alcalose79 respiratória) estão associadas ao tratamento com topiramato. Esta redução no bicarbonato sérico está relacionada ao efeito inibitório do topiramato na anidrase carbônica renal43. A redução no bicarbonato ocorre geralmente no início do tratamento, mas pode ocorrer ao longo da duração do tratamento. Estas reduções são usualmente leves a moderadas (redução média de 4 mmol/L80 em doses de 100 mg/dia ou acima em adultos e aproximadamente 6 mg/Kg/dia em pacientes pediátricos). Os pacientes raramente apresentaram redução a valores menores que 10 mmol/L80. As condições ou terapias que predispõe a acidose81 (como doença renal43, distúrbios respiratórios graves, “status epilepticus”, diarréia82, cirurgia, dieta cetogênica, ou alguns fármacos) podem ser aditivos aos efeitos do topiramato na redução do bicarbonato.
Acidose metabólica78 crônica em pacientes pediátricos pode reduzir as taxas de crescimento. O efeito do topiramato no crescimento e sequela83 relativa aos ossos não foi avaliado sistematicamente em pacientes pediátricos ou adultos.
Dependendo das condições de base, recomenda-se avaliação adequada, incluindo níveis de bicarbonato sérico, durante o tratamento com topiramato. Se a acidose metabólica78 ocorrer e persistir, deve-se considerar redução da dose ou interrupção do topiramato (usando redução gradual da dose).
Suplementação84 nutricional
A suplementação84 da dieta ou o aumento da ingestão de alimentos deve ser considerado se o paciente apresentar perda de peso durante o tratamento com topiramato.
Gravidez9 e Lactação10
Uso durante a gravidez9
Estudos em animais demonstraram toxicidade85 relacionada a reprodução86. Em ratos, o topiramato atravessou a barreira placentária.
Não foram realizados estudos adequados e bem controlados com Topamax® em gestantes.
Dados registrados sugerem que mal formações congênitas87 (como por exemplo defeitos craniofaciais, tais como lábio leporino88, hipospádia89 e anormalidades envolvendo vários sistemas corporais) podem estar associadas ao uso de Topamax® durante a gravidez9. Isto foi relatado em monoterapia com topiramato e em regimes politerápicos no qual topiramato fazia parte.
Topamax® deve ser usado durante a gravidez9 apenas se os benefícios potenciais justificarem os riscos potenciais para o feto90. No tratamento as mulheres devem ser advertidas sobre os potenciais riscos para a gravidez9, a prescrição médica deve pesar os benefícios da terapia contra os riscos potenciais. Se este medicamento está sendo usado durante a gravidez9 ou se a paciente ficar grávida durante o tratamento com este medicamento, a paciente deve ser advertida sobre os potenciais riscos para o feto90.
Uso durante a lactação10
O topiramato é eliminado no leite de ratas. A excreção do topiramato no leite humano não foi avaliada em estudos controlados. A observação em um número limitado de pacientes sugere uma excreção extensa do topiramato no leite. Uma vez que muitas drogas são excretadas no leite humano, deve-se decidir entre evitar a amamentação91 ou descontinuar o tratamento com a droga, levando-se em consideração a importância do medicamento para a mãe.
Durante a experiência pós-comercialização, casos de hipospadia89 foram relatados em bebês92 do sexo masculino expostos ao topiramato no útero93, com ou sem outros anticonvulsivantes; no entanto, uma relação causal com o topiramato não foi estabelecida.
Efeitos sobre a capacidade de dirigir veículos e operar máquinas
Topamax® age sobre o sistema nervoso central25, podendo produzir sonolência, tontura16 ou outros sintomas15 relacionados. Isto pode causar distúrbios visuais e/ou visão17 turva. Tais reações podem ser potencialmente perigosas para pacientes11 dirigindo veículos ou operando máquinas, particularmente até que se conheça a reação individual do paciente ao fármaco94.
Uso em idosos, crianças e outros grupos de pessoas
Não foram observadas diferenças farmacocinéticas relacionadas apenas à idade, embora a possibilidade de alterações da função renal43 associadas à idade deva ser considerada.
Interações Medicamentosas
Para o proposto nesta seção, uma dose sem efeito é definida como uma alteração ≤ 15%.
- Efeitos do Topamax® sobre outras drogas antiepilépticas
A associação de Topamax® a outras drogas antiepilépticas (fenitoína, carbamazepina, ácido valpróico, fenobarbital, primidona) não afeta suas concentrações plasmáticas no estado de equilíbrio, exceto, ocasionalmente, em alguns pacientes, em que a adição de Topamax® à fenitoína poderá resultar em aumento das concentrações plasmáticas de fenitoína. Isto se deve possivelmente à inibição de uma isoforma específica de uma enzima95 polimórfica (CYP2C19). Consequentemente, deverá ser realizada dosagem do nível plasmático de fenitoína em qualquer paciente em tratamento com fenitoína que apresente sinais14 ou sintomas15 de toxicidade85.
Um estudo de interação farmacocinética em pacientes com epilepsia4 demonstrou que a associação do topiramato à lamotrigina não apresentou efeito na concentração plasmática de lamotrigina no estado estacionário com doses de topiramato de 100 a 400 mg/dia. Além disso, a concentração plasmática de topiramato no estado estacionário não sofreu alteração durante ou após a retirada do tratamento com lamotrigina (dose média de 327 mg/dia).
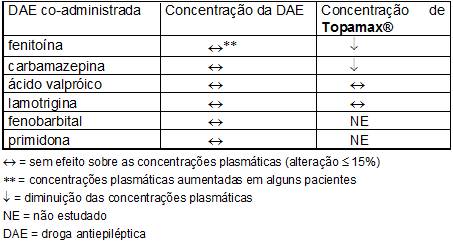
- Efeitos de outras drogas antiepilépticas sobre Topamax®
A fenitoína e a carbamazepina diminuem as concentrações plasmáticas do Topamax® . A adição ou descontinuação da fenitoína ou da carbamazepina ao tratamento com Topamax® poderá requerer um ajuste de dose deste último. A titulação da dose deverá ser realizada de acordo com o efeito clínico.
Tanto a adição quanto à retirada do ácido valpróico não produzem mudanças clinicamente significativas nas concentrações plasmáticas de Topamax® e, portanto, não exigem ajuste da dose do Topamax® . Os resultados destas interações estão resumidos na tabela a seguir.
Outras Interações Medicamentosas de Topamax
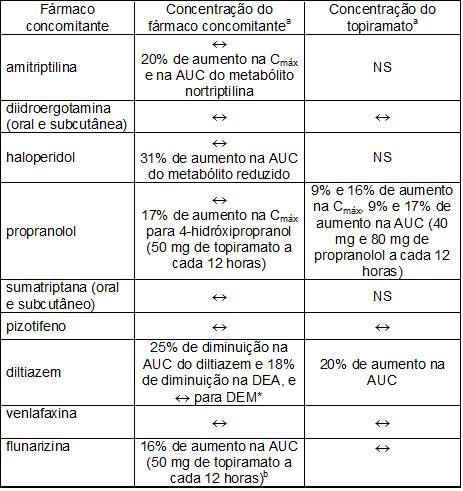
Digoxina: Em um estudo de dose única, a administração concomitante de Topamax® provocou uma redução de 12% na área sob a curva de concentração plasmática (AUC96) da digoxina. A importância clínica desta observação não foi determinada. Quando o Topamax® for associado ou descontinuado em pacientes submetidos a tratamento com a digoxina, recomenda-se atenção à monitoração rotineira e cuidadosa das concentrações séricas de digoxina.Depressores do SNC97/álcool: Não houve avaliação nos estudos clínicos, da administração concomitante de Topamax® e álcool ou outras drogas depressoras do SNC97. Recomenda-se que Topamax® não seja utilizado concomitantemente com bebidas alcoólicas ou com outros medicamentos depressores do SNC97.
Anticoncepcionais orais: Em um estudo de interação farmacocinética em voluntárias sadias, com administração concomitante de contraceptivo oral combinado contendo 1 mg de noretindrona e 35 mcg de etinilestradiol, Topamax® , administrado isoladamente nas doses de 50 a 200 mg/dia, não foi associado a alterações estatisticamente significantes na exposição média (AUC96) aos componentes do contraceptivo oral. Em outro estudo, a exposição ao etinilestradiol apresentou redução estatisticamente significante com doses de 200, 400 e 800 mg/dia (18%, 21% e 30% respectivamente) quando administrado como adjuvante em pacientes em uso de ácido valpróico. Em ambos os estudos, Topamax® (50 mg/dia a 800 mg/dia) não afetou significantemente a exposição à noretindrona. Entretanto, nas doses entre 200-800 mg/dia, houve uma redução dose-dependente na exposição ao etinilestradiol e, nas doses de 50-200 mg/dia, não houve alteração significante dose-dependente na exposição ao etinilestradiol.
A significância clínica das alterações observadas não é conhecida. A possibilidade de redução da eficácia do contraceptivo e aumento no sangramento de escape deve ser considerada em pacientes em uso de contraceptivos orais combinados e Topamax® . Deve-se solicitar a pacientes em uso de contraceptivos orais que relatem qualquer alteração em seus padrões menstruais. A eficácia contraceptiva pode ser reduzida, mesmo na ausência de sangramento de escape.
Lítio: Em voluntários saudáveis, foi observada uma redução (18% para AUC96) na exposição sistemática para o lítio durante a administração concomitante com topiramato 200 mg/dia. Nos pacientes com transtorno bipolar, a farmacocinética do lítio não foi afetada durante o tratamento com topiramato em doses de 200 mg/dia; entretanto, foi observado aumento na exposição sistêmica (26% para AUC96) depois de doses do topiramato de até 600 mg/dia. Os níveis do lítio devem ser monitorados quando co-administrados com topiramato.
Risperidona: os estudos de interação droga-droga conduzidos sob condições de dose única e múltipla em voluntários saudáveis e em pacientes com transtorno bipolar atingiram resultados similares. Quando administrado concomitantemente com topiramato em doses escaladas de 100, 250 e 400 mg/dia houve uma redução da risperidona (administrada em doses que variando de 1 a 6 mg/dia) na exposição sistêmica (16% e 33% para AUC96 no estado de equilíbrio nas 250 e 400 doses de mg/dia, respectivamente). Alterações mínimas na farmacocinética do total de partes ativas (risperidona mais 9-hidroxirisperidona) e nenhuma alteração para 9-hidroxirisperidona foi observada. Não houve mudança clínica significativamente na exposição sistemica do total de partes ativas da risperidona ou do topiramato, portanto esta interação não é provável ser de significância clínica.
Hidroclorotiazida: Um estudo de interação medicamentosa conduzido em voluntários sadios avaliou a farmacocinética no estado estacionário da hidroclorotiazida (25 mg a cada 24h) e do topiramato (96 mg a cada12h) quando administrados isolada ou concomitantemente. Os resultados deste estudo indicaram que a Cmáx do topiramato aumentou 27% e a AUC96 aumentou 29% quando a hidroclorotiazida foi associada ao topiramato. A significância clínica desta alteração é desconhecida. A associação de hidroclorotiazida ao tratamento com topiramato pode precisar de um ajuste da dose do topiramato. A farmacocinética da hidroclorotiazida no estado estacionário não foi influenciada significativamente pela administração concomitante do topiramato. Os resultados laboratoriais clínicos indicaram redução no potássio sérico após administração do topiramato ou da hidroclorotiazida, sendo maior quando a hidroclorotiazida e o topiramato foram administrados em combinação.
Metformina23: Um estudo de interação medicamentosa conduzido em voluntários sadios avaliou a farmacocinética da metformina23 e do topiramato no estado de equilíbrio no plasma49 quando a metformina23 foi administrada isolada e quando a metformina23 e o topiramato foram administrados simultaneamente. Os resultados do estudo indicaram que a Cmax média e a AUC0-12 h média da metformina23 aumentaram em 18% e 25%, respectivamente, enquanto que o “clearance” médio diminuiu 20% quando a metformina23 foi co-administrada com topiramato. O topiramato não afeta o Tmax da metformina23. A significância clínica do efeito do topiramato na farmacocinética da metformina23 não está clara. O “clearance” plasmático oral do topiramato parece ser reduzido quando administrado com metformina23. A extensão da alteração no “clearance” é desconhecida. A significância clínica do efeito da metformina23 na farmacocinética do topiramato não está clara. Quando Topamax® é administrado ou retirado em pacientes tratados com metformina23, deve-se ter especial atenção na monitorização rotineira para um controle adequado do diabetes27.
Pioglitazona: Um estudo de interação medicamentosa conduzido em voluntários sadios avaliou a farmacocinética no estado estacionário do topiramato e da pioglitazona quando administrados isolada ou concomitantemente. Uma redução de 15% na AUC96, ss de pioglitazona sem alteração na Cmáx, ss foi observada. Este achado não foi estatisticamente significante. Além disso, reduções de 13% na Cmáx, ss e de 16% na AUC96, ss do hidróxi-metabólito50 ativo foram observadas, assim como uma redução de 60% tanto na Cmáx, ss como na AUC96, ss do ceto-metabólito50 ativo foram observadas. A significância clínica destes achados é desconhecida. Quando Topamax® é associado ao tratamento com pioglitazona ou pioglitazona é associada ao tratamento com Topamax® , deve-se ter atenção especial à rotina de monitoramento dos pacientes para um controle adequado do estado diabético.
Gliburida: Um estudo de interação droga-droga conduzido nos pacientes com diabetes tipo 298 avaliou a farmacocinética no estado de equilíbrio da gliburida (5 mg/dia) isolada e concomitantemente com topiramato (150 mg/dia). Houve uma redução de 25% na AUC96 da gliburida durante a administração do topiramato. A exposição sistêmica dos metabolitos45 ativos, 4-trans-hidroxi-gliburida (M1) e 3-cis-hidróxi-gliburida (M2), também foram reduzidas em 13% e 15%, respectivamente. A farmacocinética no estado de equilíbrio do topiramato não foi afetada pela administração concomitante da gliburida. Quando o topiramato é adicionado a terapia da gliburida ou a gliburida é adicionada a terapia do topiramato, deve ser feita uma rotina de monitorização cuidadosa dos pacientes para o controle adequado do estado da sua doença diabética.
Outras Formas de Interação:
Agentes que predispõem à nefrolitíase
Topamax® pode aumentar o risco de nefrolitíase em pacientes em uso concomitante de outros agentes que predispõem à nefrolitíase. Durante o tratamento com Topamax® , tais agentes deverão ser evitados, uma vez que eles criam um ambiente fisiológico99 que aumenta o risco de formação de cálculo62 renal43.
Ácido valpróico
A administração concomitante do topiramato e do ácido valpróico foi associada com hiperamonemia com ou sem encefalopatia100 nos pacientes que toleraram uma ou outra droga isolada. Na maioria dos casos, os sintomas15 e os sinais14 cessaram com a descontinuação de uma ou outra droga. Este evento adverso não é devido a uma interação farmacocinética. Uma associação de hiperamonemia com monoterapia do topiramato ou do tratamento concomitante com outros antiepilépticos não foi estabelecida.
Estudos adicionais de interação medicamentosa farmacocinética: Estudos clínicos foram conduzidos para avaliar a interação medicamentosa farmacocinética potencial entre o topiramato e outros agentes. As alterações na Cmáx e na AUC96 como resultado das interações estão descritas a seguir. A segunda coluna (concentração do fármaco94 concomitante) descreve o que acontece com a concentração do fármaco94 concomitante listado na primeira coluna quando topiramato é associado. A terceira coluna (concentração do topiramato) menciona como a co-administração do fármaco94 listado na primeira coluna modifica a concentração do topiramato.
Resumo dos resultados dos estudos adicionais de interação medicamentosa farmacocinética
Reações Adversas a Medicamentos
Dados de estudos clínicos
A segurança de Topamax® foi avaliada a partir de um banco de dados de estudos clínicos composto de 4.111 pacientes (3.182 tratados com Topamax® e 929 com placebo38) que participaram de 20 estudos duplo-cegos e 2.847 pacientes que participaram de 34 estudos abertos, respectivamente, para o tratamento de convulsões tônico-clônicas generalizadas primárias, convulsões de início parcial, convulsões associadas à síndrome35 de Lennox-Gastaut, epilepsia4 ou enxaqueca5 de diagnóstico36 novo ou recente. As informações apresentadas neste item foram obtidas a partir de dados agrupados.
A maioria das reações adversas foi de gravidade leve a moderada.
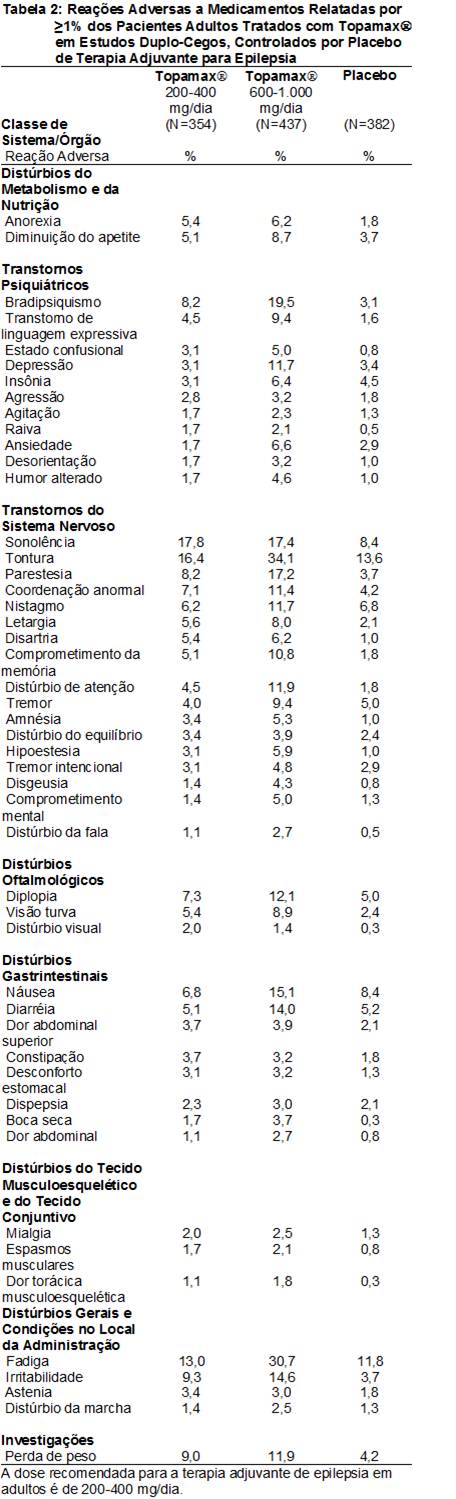
Dados de estudos duplo-cegos, controlados por placebo38, de terapia adjuvante para epilepsia4 – Pacientes adultos.
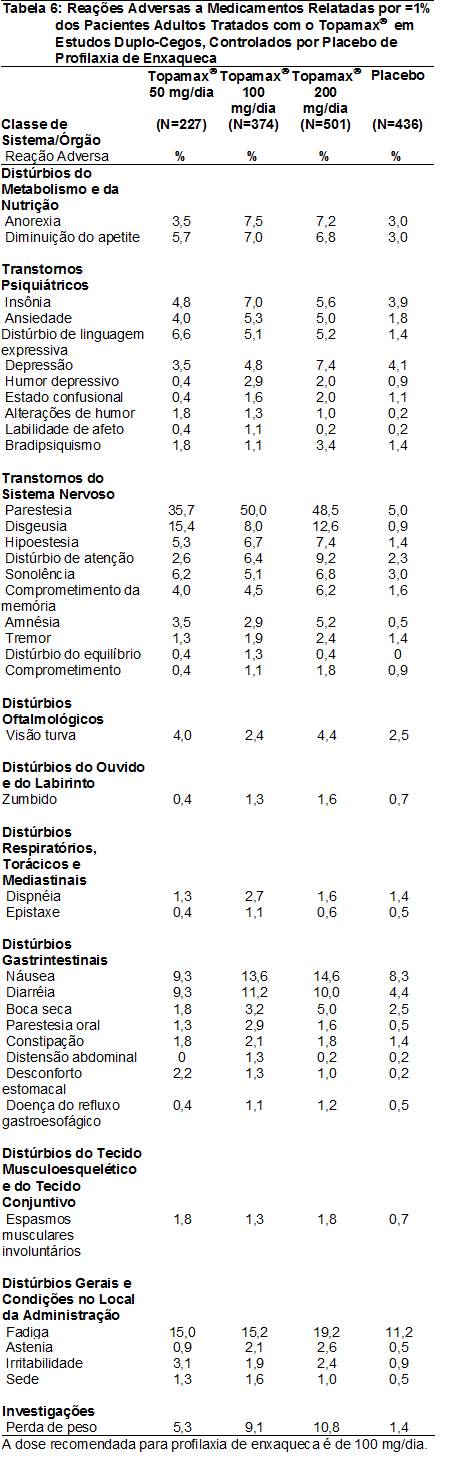
As Reações Adversas a Medicamentos (RAMs) relatadas em ≥1% dos pacientes adultos tratados com o Topamax® em estudos duplo-cegos, controlados por placebo38 de terapia adjuvante para epilepsia4 são apresentadas na Tabela 2. As RAMs com incidência60 >5% no intervalo de dose recomendado (200 a 400 mg/dia) em adultos em estudos duplo-cegos, controlados por placebo38 de terapia adjuvante para epilepsia4 em ordem decrescente de freqüência incluíram sonolência, tontura16, fadiga101, irritabilidade, perda de peso, bradipsiquismo, parestesia102, diplopia103, coordenação anormal, náusea18, nistagmo104, letargia105, anorexia106, disartria107, visão17 turva, diminuição do apetite, comprometimento de memória e diarréia82.
Dados de estudos duplo-cegos, controlados por placebo38, de terapia adjuvante para epilepsia4 – Pacientes pediátricos
As RAMs relatadas em >2% dos pacientes pediátricos tratados com o Topamax® (2 a 16 anos de idade) em estudos duplo-cegos, controlados por placebo38 de terapia adjuvante para epilepsia4 são apresentadas na Tabela 3. As RAMs com incidência60 >5% no intervalo de dose recomendado (5 a 9 mg/Kg/dia) em ordem decrescente de frequência incluíram diminuição do apetite, fadiga101, sonolência, letargia105, irritabilidade, distúrbio de atenção, perda de peso, agressão, erupção108 cutânea109, comportamento anormal, anorexia106, distúrbio do equilíbrio e constipação110.
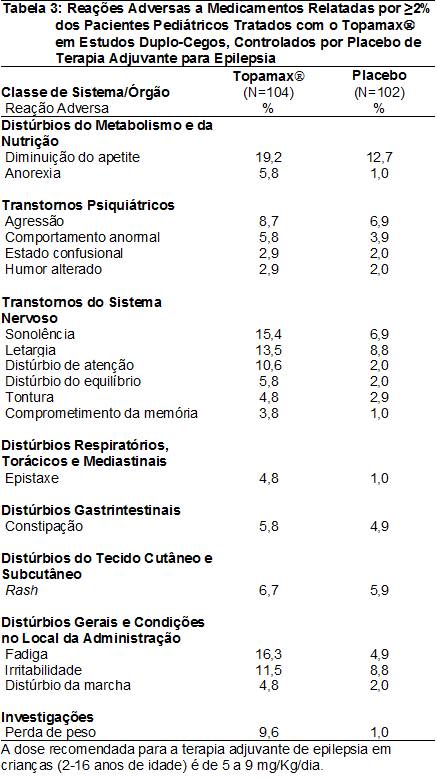
Dados dos estudos duplo-cegos, controlados e de monoterapia para epilepsia4 – Pacientes adultos
As RAMs relatadas em ≥1% dos pacientes adultos tratados com o TopamaxÒ em estudos duplo-cegos, controlados e de monoterapia para epilepsia4 são apresentadas na Tabela 4. As RAMs que apresentaram incidência60 >5% na dose recomendada (400 mg/dia) em ordem decrescente de freqüência incluíram parestesia102, perda de peso, fadiga101, anorexia106, depressão, comprometimento da memória, ansiedade, diarréia82, astenia111, disgeusia112 e hipoestesia113.
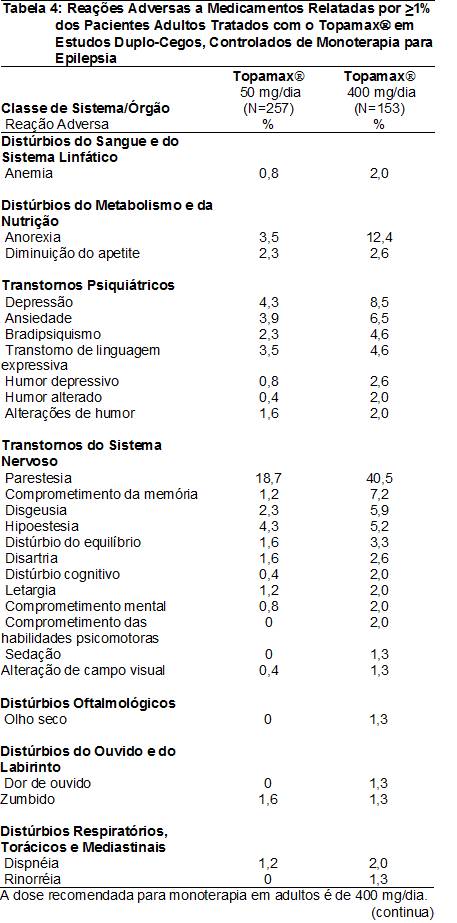
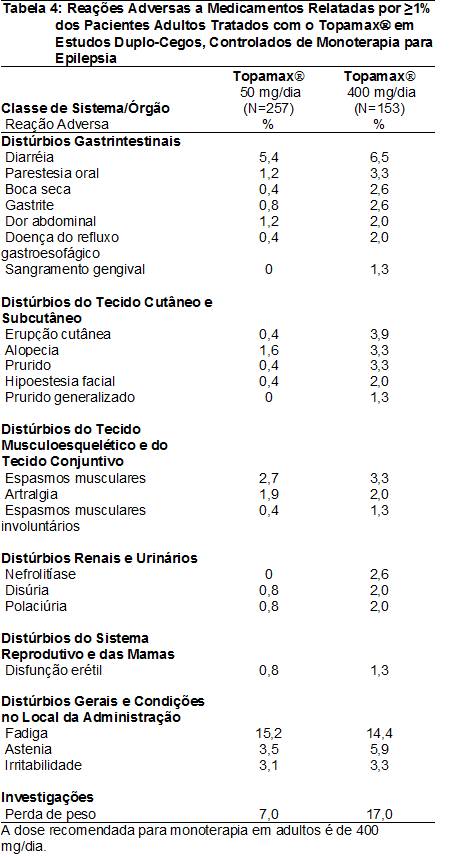
Dados de estudos duplo-cegos, controlados e de monoterapia para epilepsia4 – Pacientes pediátricos
As RAMs relatadas em ≥2% dos pacientes pediátricos tratados com o Topamax® (10 a 16 anos de idade) em estudos duplo-cegos, controlados e de monoterapia para epilepsia4 são apresentadas na Tabela 5. As RAMs com incidência60 >5% na dose recomendada (400 mg/dia) em ordem decrescente de freqüência incluíram perda de peso, parestesia102, diarréia82, distúrbio de atenção, pirexia114, e alopecia115.
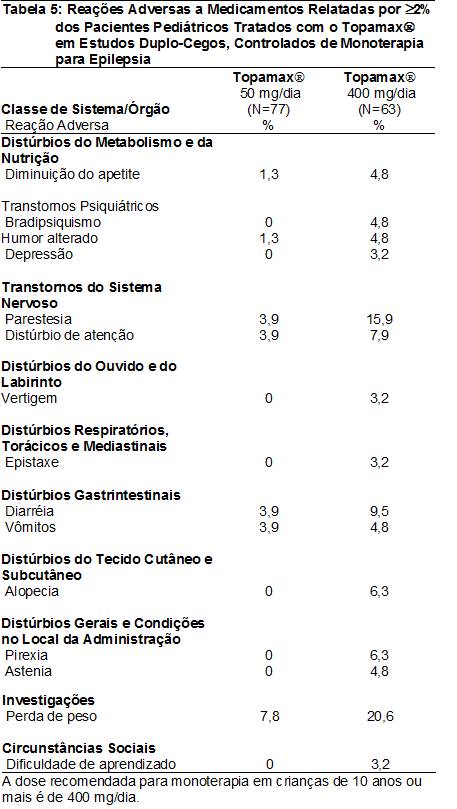
Dados de estudos duplo-cegos, controlados por placebo38, de profilaxia de enxaqueca5 – Pacientes adultos
As RAMs relatadas em ≥1% dos pacientes adultos tratados com o Topamax® em estudos duplo-cegos, controlados por placebo38 de profilaxia de enxaqueca5 são apresentadas na Tabela 6. As RAMs com incidência60 >5% na dose recomendada (100 mg/dia) em ordem decrescente de freqüência incluíram parestesia102, fadiga101, náusea18, diarréia82, perda de peso, disgeusia112, anorexia106, diminuição do apetite, insônia, hipoestesia113, distúrbio de atenção, ansiedade, sonolência, e transtorno de linguagem expressiva.
Outros Dados de Estudos Clínicos
As RAMs relatadas em estudos clínicos duplo-cegos controlados em <1% dos pacientes adultos tratados com o Topamax® ou em qualquer taxa em estudos clínicos abertos em pacientes adultos tratados com o Topamax® são apresentadas na Tabela 7.

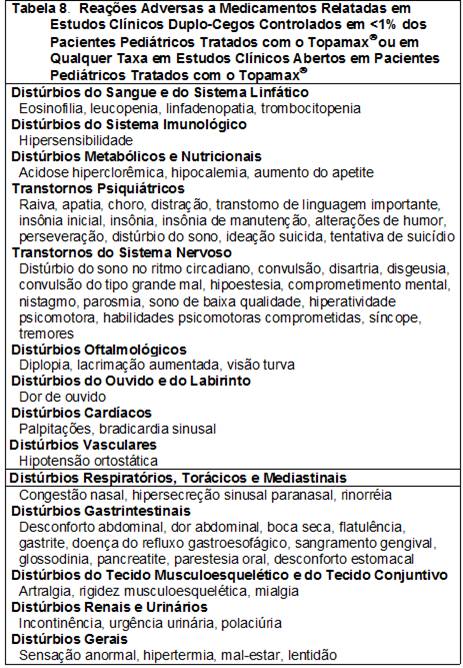
As RAMs relatadas em estudos clínicos duplo-cegos controlados em <1% dos pacientes pediátricos tratados com o Topamax® ou em qualquer taxa em estudos clínicos abertos em pacientes pediátricos tratados com o Topamax® são apresentadas na Tabela 8.
Dados Pós-Comercialização
Os eventos adversos primeiramente identificados como RAMs durante a experiência pós-comercialização com o Topamax® estão mencionados na Tabelas 9. Na tabela, as freqüências são apresentadas de acordo com a seguinte convenção:
| Muito comum | ≥1/10 |
| Comum | ≥1/100 a <1/10 |
| Incomum | ≥1/1.000 a <1/100 |
| Raro | ≥1/10.000 a <1/1.000 |
| Muito raro | <1/10.000, incluindo relatos isolados |

Superdose
Sinais14 e sintomas15
Superdose de topiramato tem sido relatada. Sinais14 e sintomas15 incluem convulsão116, sonolência, distúrbio da fala, visão17 borrada, diplopia103, atividade mental prejudicada, letargia105, coordenação anormal, estupor, hipotensão117, dor abdominal, agitação, vertigem118 e depressão. As conseqüências clínicas não foram graves na maioria dos casos, mas foram relatados casos de óbitos após superdoses com diversas drogas, incluindo o topiramato.
Superdose com topiramato pode resultar em acidose metabólica78 grave (ver item “Precauções e Advertências”).
A maior superdose relatada com topiramato foi calculada em 96-110 g e resultou em coma119 com duração de 20-24 horas seguido de recuperação total após 3 a 4 dias.
Tratamento
Medidas gerais de suporte são indicadas e uma tentativa deve ser feita para remover o fármaco94 não digerido do trato gastrintestinal utilizando lavagem gástrica120 ou carvão ativado. A hemodiálise52 é um método eficaz para a retirada do topiramato do organismo. O paciente deve ser bem hidratado.
Modo de Administrar Topamax® Cápsulas
As cápsulas de Topamax® podem ser tomadas inteiras ou podem ser abertas e seu conteúdo misturado com alimento, de acordo com as instruções abaixo.
 | Você deve espalhar o conteúdo da cápsula de Topamax® sobre uma pequena quantidade (uma colher das de chá) de alimento pastoso como purê de maçã, sorvete, mingau, pudim ou iogurte. |
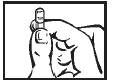 | Segure a cápsula na vertical, com a palavra “TOP” para cima. |
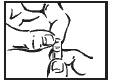 | Torça a porção clara da cápsula com cuidado, de preferência sobre o alimento que será administrado ao paciente. |
 | Espalhe todo o conteúdo da cápsula sobre a colher com o alimento pastoso, certificando-se que a dose prescrita tenha sido adicionada ao alimento. |
 | O alimento contendo o medicamento deve ser ingerido imediatamente, não devendo ser mastigado. A administração de líquidos ao paciente logo após a ingestão irá garantir que a mistura alimento/medicamento seja totalmente deglutida. IMPORTANTE: nunca guarde a mistura para uso posterior. |
Topamax - Laboratório
JANSSEN- CILAG FARMACÊUTICA LTDA.
Rod. Presidente Dutra, km 154
São José dos Campos/SP
Tel: 08007011851
Ver outros medicamentos do laboratório "JANSSEN- CILAG FARMACÊUTICA LTDA."






